2.1แบบจำลองอะตอม (Atomic Model)
แบบจำลองอะตอมของจอร์น ดอลตัน
ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอม
เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้
1. ธาตุประกอบด้วยอนุภาคเล็กๆหลายอนุภาคเรียกอนุภาคเหล่านี้ว่า “อะตอม” ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน แต่จะมีสมบัติ แตกต่างจากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยา เคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
จอห์น ดอลตัน ชาวอังกฤษ เสนอทฤษฎีอะตอมของดอลตัน
- อะตอมเป็นอนุภาคที่เล็กที่สุด แบ่งแยกอีกไม่ได้
- อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน
- อะตอมต้องเกิดจากสารประกอบเกิดจากอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมตัวกันทางเคมี
ทฤษฎีอะตอมของดอลตันใช้อธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง แต่ต่อมานักวิทยาศาสตร์ค้นพบข้อมูลบางประการที่ไม่สอดคล้องกับทฤษฎีอะตอมของ ดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันอาจมีมวลแตกต่างกันได้
ลักษณะแบบจำลองอะตอมของดอลตัน
ทรงกลมตันมีขนาดเล็กที่สุดซึ้งแบ่งแยกอีกไม่ได้
แบบจำลองอะตอมของทอมสัน
เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด
หลอดรังสีแคโทด
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด
การค้นพบอิเล็กตรอน
เซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่ ดังรูป
รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะลุออกไปกระทบกับฉากเรืองแสง
หลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทดดังรูป
ปรากฎว่า รังสีนี้จะเบี่ยงเบนเข้าหาขั้วบวก แสดงว่า รังสีนี้ต้องเป็นประจุลบ แต่ไม่ทราบว่าเกิดจากก๊าซในหลอดรังสีแคโทด หรือเกิดจากขั้วไฟฟ้าทอมสันจึงทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่า ไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้ผลการทดลองเหมือนเดิม จึงสรุปได้ว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า "อิเล็กตรอน"
การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป
ผลการทดลองของโกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซไม่ได้เกิดจากขั้วไฟฟ้า
สรุปแบบจำลองของทอมสัน
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้ อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด ได้ทำการทดลอง โดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำดังรูป
ผลการทดลอง สรุปได้ดังนี้
• จุด X เป็นจุดที่อนุภาคแอลฟาผ่านไปยังฉากในแนวเส้นตรง แสดงว่า ภายในอะตอมน่าจะมีพื้นที่ว่างเป็นจำนวนมาก เพราะ อนุภาคแอลฟาส่วนใหญ่ทะลุผ่านแผนทองคำเป็นแนวเส้นตร ง
• จุด Y อนุภาคแอลฟาเบี่ยงเบนเล็กน้อย แสดงว่าภายในอะตอมควรมีอนุภาคบางอย่างรวมกันเป็นกลุ่มก้อนขนาดเล็ก มีมวลมากพอที่ทำให้อนุภาคแอลฟาวิ่งไปเฉียดแล้วเบี่ยงเบน
• จุด Z อนุภาคแอลฟาสะท้อนกลับ แสดงว่าในอะตอมจะมีอนุภาคบางอย่างที่เป็นกลุ่มก้อน มีทวลมากพอที่ทำให้อนุภาคแอลฟาสะท้อนกลับ
การค้นพบนิวตรอน
สาเหตุที่ค้นพบนิวตรอน
1. เนื่อจากมวลของอะตอมต่าง มักเป็น 2 เท่า หรือมากกว่า 2 เท่าของมวลโปรตรอนรวมรัทเทอร์ฟอร์ดสันนิษฐานว่า น่าจะมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส และอนุภาคนี้ต้องมีมวลใกล้เคียงกันกับมวลของโปรตรอนมาก และต้องเป็นกลางทางไฟฟ้า
2. ทอมสันศึกษาหามวลของอนุภาคบวกของ Ne ปรากฎว่า อนุภาคบวกนี้มีมวล 2 เท่า ผลการทดลองนี้สนับสนุนว่าจะต้องมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียสเชดวิก ได้ยิงอนุภาคแอลฟาไปยัง Be ปรากฎว่าได้อนุภาคชนิดนึ่งออกมาซึ่งมีมวลใกล้เคียงกับมวลของโปรตรอนและไม่มีประจุไฟฟ้า เรียกอนุภาคนี้ว่า "นิวตรอน"
สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
สเปกตรัม
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือ หรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้นที่มีความยาวคลื่นต่าง ๆ เรียงลำดับกันไป
สเปกตรัมของอะตอม (atomic spectrum)
คลื่นแม่เหล็กไฟฟ้าในช่วงแสงขาวประกอบด้วยแสงที่มีความยาวคลื่นหลายค่าซึ่งเราไม่สามารถแยกส่วนประกอบของคลื่นต่าง ๆ ออกจากกันด้วยตาได้ ต้องใช้เครื่องมือช่วย เช่น ปริซึม หรือสเปกโตรสโคป (spectroscope) เมื่อเราผ่านแสงสีขาวหรือแสงสีต่าง ๆ ไปยังปริซึม แสงจะแยกออกมาเป็นแถบสีต่าง ๆ เรียงกันตามความยาวคลื่น แถบสีที่แยกออกมาได้เรียกว่า สเปกตรัม
แบ่งเป็น 2 ประเภท ดังนี้
1. สเปกตรัมแบบต่อเนื่อง (continuous spectrum) จะเป็นสเปกตรัมที่ประกอบด้วยแสงที่มีความยาวคลื่นและความถี่ต่อเนื่องจนเห็นเป็นแถบ ได้แก่ สเปกตรัมของแสงขาวซึ่งจะเห็นเป็นแถบสีรุ้งเรียงต่อกัน โดยแสงสีม่วงหักเหมากที่สุด มีความยาวคลื่นสั้น แต่มีพลังงานมากที่สุด ในขณะที่แสงสีแดงจะหักเหน้อยที่สุด มีความยาวคลื่นยาวที่สุด และมีพลังงานน้อยที่สุด
2. สเปกตรัมแบบไม่ต่อเนื่องหรือแบบเส้น (Discontinuous spectrum or Line spectrum) เป็นสเปกตรัมที่ประกอบด้วยเส้นสเปกตรัมที่มีความยาวคลื่นบางค่าเว้นระยะเป็นเส้น ๆ บนพื้นดำ เนื่องจากสเปกตรัมแต่ละเส้นเป็นคลื่นแม่เหล็กไฟฟ้า เราจึงสามารถคำนวณหาค่าพลังงานของเส้นสเปกตรัมแต่ละเส้นได้จากสมการ
ความยาวคลื่น (Wavelength) l ( แลมบ์ดา ) หมายถึง ระยะทางที่คลื่นเคลื่อนที่ครบ 1 รอบพอดี มีหน่วยเป็นเมตร ( m )
หรือหน่วยย่อยของเมตร เช่น นาโนเมตร (nm) โดย 1 nm = 10-9 เมตร
ความถี่ของคลื่น n (นิว) หมายถึง จำนวนรอบของคลื่นที่เคลื่อนที่ผ่านจุดใดจุดหนึ่งในเวลา 1 วินาที
มีหน่วยเป็นจำนวนรอบต่อวินาที หรือ เฮิร์ตซ์ (Hertz) หรือ Hz
แอมปลิจูด (Amplitude) คือ ความสูงของยอดคลื่น
คลื่นที่จะศึกษากันในที่นี้เป็นคลื่นแม่เหล็กไฟฟ้าในช่วงความยาวคลื่นระหว่าง 380 ถึง 750 nmซึ่งเป็นช่วงคลื่นที่มีความยาวและความถี่ที่ประสาทตาของคนจะรับได้ เรียกคลื่นแม่เหล็กไฟฟ้าช่วงดังกล่าวนี้ว่า “แสงขาว (Visibel light)”
ดูตัวอย่างการคำนวณความยาวคลื่น ความถี่และพลังงาน

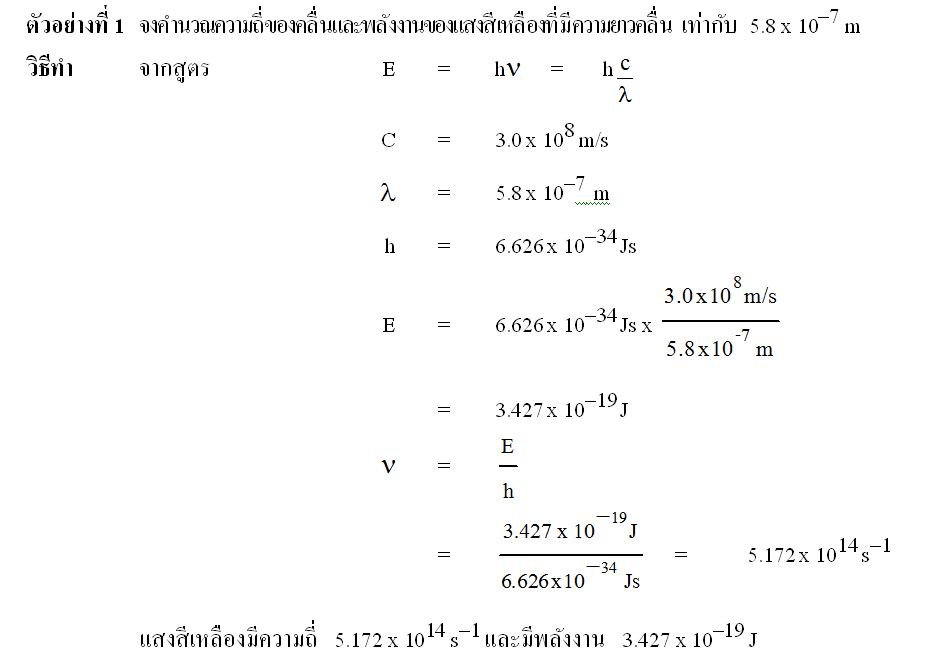
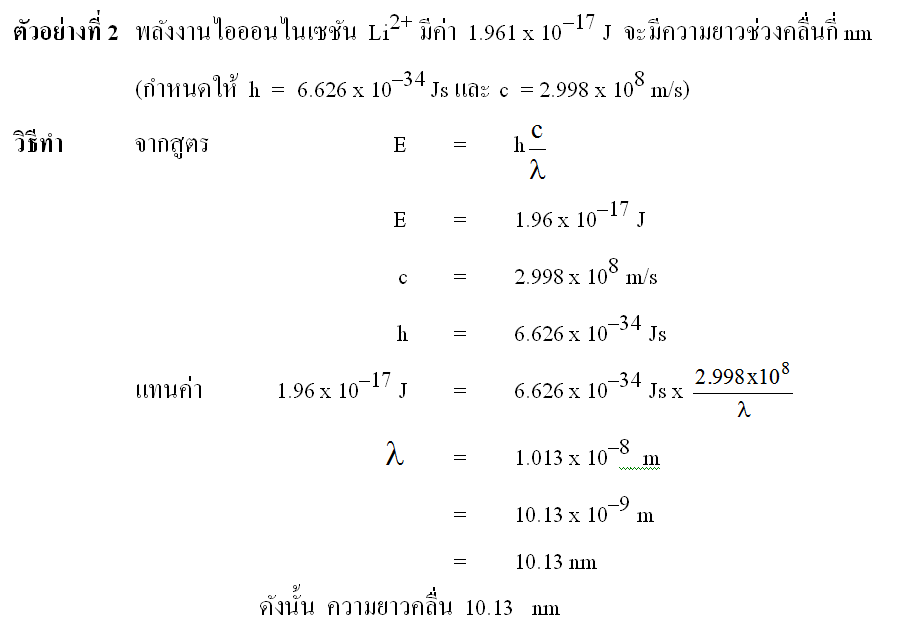
สเปกตรัมเกิดได้อย่างไร
สถานะพื้น (ground state)
หมายถึงอะตอมที่อิเล็กตรอนซึ่งเคลื่อนที่อยู่รอบนิวเคลียสมีพลังงานเฉพาะตัวอยู่ในระดับพลังงานต่ำ อะตอมในสถานะพื้นจะมีความเสถียรเนื่องจากมีพลังงานต่ำ
สถานะกระตุ้น (excited state)
หมายถึงอะตอมที่ได้รับพลังงานเพิ่มขึ้น ทำให้อิเล็กตรอนถูกกระตุ้นให้อยู่ในระดับพลังงานสูงขึ้น ที่สถานะกระตุ้นอะตอมจะไม่เสถียร เนื่องจากมีพลังงานสูง

อะตอมที่ได้รับพลังงาน เช่น จากการเผา หรือจากกระแสไฟฟ้า อิเล็กตรอนจะเปลี่ยนจากสถานะพื้นไปสู่สถานะกระตุ้นซึ่งไม่เสถียร จึงต้องคายพลังงานออกมา ซึ่งพลังงานที่คายออกมาจะอยู่ในรูปพลังงานแสงหรือคลื่นแม่เหล็กไฟฟ้า เมื่อผ่านปริซึมหรือสเปกโตรสโคปจะแยกแสงออกเป็นเส้นสเปกตรัม
การที่ธาตุแต่ละชนิดให้เส้นสเปกตรัมออกมาหลายเส้น แสดงว่าอิเล็กตรอนที่อยู่รอบนิวเคลียสมีหลายระดับพลังงาน ระดับพลังงานที่อยู่ใกล้นิวเคลียสจะมีพลังงานต่ำ ส่วนระดับพลังงานที่อยู่ห่างนิวเคลียสจะมีพลังงานสูง เมื่ออิเล็กตรอนคายพลังงานอาจคายพลังงานได้หลายช่วงความยาวคลื่น จึงมองเห็นเส้นสเปกตรัมได้หลายเส้น
นักวิทยาศาสตร์ได้ศึกษาสเปกตรัมของแก๊ส เพราะว่ามีอะตอมอยู่ห่างกัน และใช้อะตอมไฮโดรเจนเนื่องจากมี 1 อิเล็กตรอน พบว่ามีเส้นสเปกตรัมที่ปรากฏในช่วงความยาวคลื่นที่มองเห็นได้โดยมีความยาวคลื่น 410 , 434 , 486 และ 656 นาโนเมตร ตามลำดับ นอกจากนี้การศึกษาเส้นสเปกตรัมของอะตอมของธาตุอื่นๆ ก็พบว่าอิเล็กตรอนในอะตอมของแต่ละธาตุคายพลังงานได้บางค่า และมีเส้นสเปกตรัมเฉพาะตัวไม่ซ้ำกัน โดยเส้นสีแดงมีพลังงานต่ำสุด (3.02 x 10–22 kJ) และเส้นสีม่วงมีพลังงานสูงสุด (4.48 x 10–22 kJ)

การที่นักวิทยาศาสตร์ใช้อะตอมของไฮโดรเจนเป็นตัวอย่างในการแปลความหมายของเส้นสเปกตรัม เพราะเป็นอะตอมที่มีอิเล็กตรอนเดียว จากการทดลองหลายครั้งพบว่าอะตอมของไฮโดรเจนให้เส้นสเปกตรัมได้หลายเส้นที่มีลักษณะเหมือนกันทุกครั้ง จึงสรุปได้ว่าอิเล็กตรอนในอะตอมของไฮโดรเจนขึ้นไปอยู่ในสถานะกระตุ้นที่มีพลังงานแตะต่างกันได้หลายระดับ ค่าพลังงานของเส้นสเปกตรัมแสดงให้เห็นถึงการเปลี่ยนระดับพลังงานของอิเล็กตรอนในอะตอมจากระดับพลังงานสูงมายังระดับพลังงานต่ำ


จากข้อมูลในตาราง แสดงว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับและความแตกต่างระหว่างพลังงานของแต่ละระดับที่อยู่ถัดไปก็ไม่เท่ากัน ความแตกต่างของพลังงานจะมีค่าน้อยลงเมื่อระดับพลังงานสูงขึ้น จากเหตุผลที่อธิบายมานี้ช่วยให้สรุปได้ว่า
1. เมื่ออิเล็กตรอนได้รับพลังงานในปริมาณที่เหมาะสม อิเล็กตรอนจะขึ้นไปอยู่ในระดับพลังงานที่สูงกว่าระดับพลังงานเดิม แต่จะอยู่ในระดับใดขึ้นกับปริมาณพลังงานที่ได้รับ การที่อิเล็กตรอนขึ้นไปอยู่ในระดับพลังงานใหม่ทำให้อะตอมไม่เสถียร อิเล็กตรอนจะกลับมาอยู่ในระดับพลังงานที่ต่ำกว่า ซึ่งในการเปลี่ยนตำแหน่งนี้อิเล็กตรอนจะคายพลังงานออกมา การดูดหรือคายพลังงานจะต้องมีค่าเฉพาะตามทฤษฎีของพลังค์ โดยค่าต่ำสุดจะเท่ากับความถี่ของอิเล็กตรอนนั้นคูณด้วยค่าคงที่ของพลังค์
2. การเปลี่ยนระดับพลังงานของอิเล็กตรอนไม่จำเป็นต้องเปลี่ยนไปยังระดับพลังงานที่อยู่ติดกันอาจมีการเปลี่ยนข้ามระดับได้ แต่เมื่ออิเล็กตรอนรับพลังงานแล้วจะขึ้นไปอยู่ระหว่างระดับพลังงานไม่ได้ จะต้องขึ้นไปอยู่ในระดับใดระดับหนึ่งเสมอ
3. ผลต่างของพลังงานระหว่างระดับพลังงานต่ำจะมีค่ามากกว่าผลต่างของพลังงานระหว่างระดับพลังงานที่สูงขึ้นไป
แบบจำลองอะตอมของบอห์ร
นีลส์ บอห์ร ( Neils Bohr 1885 - 1962 : Denmark )
จากความรู้เรื่องสเปกตรัม นีลส์ บอห์ร ได้เสนอแบบจำลองขึ้นมาใหม่โดยปรับปรุงแบบจำลองอะตอมของรัทเทอร์ฟอร์ด เพื่อให้เห็นลักษณะของอิเล็กตรอนที่อยู่รอบ ๆ นิวเคลียส เป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ ดังรูป
สรุปแบบจำลองอะตอมของบอห์ร
1. อิเล็กตรอนจะอยู่เป็นชั้น ๆ แต่ละชั้นเรียกว่า “ ระดับพลังงาน ”
2. แต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุได้ดังนี
จำนวนอิเล็กตรอน = 2n2
3. อิเล็กตรอนที่อยู่ในระดับพลังงานนอกสุดเรียกว่า เวเลนซ์อิเล็กตรอน ( Valence electron ) จะเป็นอิเล็กตรอนทีเกิดปฏิกิริยาต่าง ๆ ได้
4. อิเล็กตรอนที่อยู่ในระดับพลังงานวงใน อยู่ใกล้นิวเคลียสจะเสถียรมาก เพราะประจุบวกจากนิวเคลียสดึงดูด
เอาไว้อย่างดี ส่วนอิเล็กตรอนระดับพลังงานวงนอกจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก จึงทำให้อิเล็กตรอนเหล่านี้หลุดออกจากอะตอมได้ง่าย
5. ระดับพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
6. การเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับพลังงานก็ได้
สรุปการเกิดสเปกตรัม
1. การตรวจหาสเปกตรัม ถ้าเป็นสารประกอบทำโดย การเผาสารประกอบถ้าเป็นก๊าซทำโดย นำก๊าซมาบรรจุในหลอดแก้ว แล้วปรับความดันให้ต่ำแล้วใช้พลังงานไฟฟ้าแทนการเผา
2. สีเปลวไฟ หรือสเปกตรัม เกิดจากสาเหตุเดียวกัน ข้อแตกต่าง คือ
สีเปลวไฟ เป็นสีที่มองจากตาเปล่า จะเห็นเป็นสีเดียว ซึ่งเป็นสีที่เด่นชัดที่สุด
สีสเปกตรัมเป็นสีที่ใช้เครื่องมือ สเปกโตรสโคป ส่องดูเปลวไฟ จะเห็นเป็นเส้นสเปกตรัมหลายเส้น และความเข้มมากที่สุดจะเป็นสีเดียวกันกับสีของเปลวไฟ
3. สีของเปลวไฟ หรือสีของสเปกตรัมเป็นสีที่เกิดที่เกิดจากส่วนที่เป็นไอออนของโลหะ หรือไอออนบวกนั่นเอง ดังเช่น
Li+ สีแดง , Na+ สีเหลือง , K+ สีม่วง , Ca2+ สีแดงอิฐ ,
Ba2+ สีเขียวอมเหลือง , Cu2+ สีเขียว
4. ธาตุแต่ละธาตุมีเส้นสเปกตรัมเป็นลักษณะเฉพาะตัวไม่ซ้ำกัน ดังรูป
การจัดอิเล็กตรอนในอะตอม จากการศึกษาแบบจำลองอะตอมของบอห์ร ทำให้ทราบว่า การจัดอิเล็กตรอนในระดับพลังงานต่างๆ
ระดับพลังงาน(n) จำนวนอิเล็คตรอนที่มีได้สูงสุด
n = 1 2
n = 2 8
n = 3 18
n = 4 32
n = 5 50
n = 6 72
n = 7 98
เวเลนซ์อิเล็กตรอน คือ จำนวนอิเล็กตรอนในระดับพลังงานนอกสุดหรือสูงสุด ของแต่ละธาตุจะมีอิเล็กตรอนไม่เกิน 8
การจัดอิเล็กตรอน มีความสัมพันธ์กับการจัดหมู่และคาบอย่างไร
1. เวเลนซ์อิเล็กตรอน จะตรงกับเลขที่ของหมู่ ดังนั้น ธาตุที่อยู่หมู่เดียวกันจะมีเวเลนซ์อิเล็กตรอนเท่ากัน
2. จำนวนระดับพลังงาน จะตรงกับเลขที่ของคาบ ดังนั้น ธาตุในคาบเดียวกันจะมีจำนวนระดับพลังงานเท่ากัน เช่น 35Br มีการจัดเรียงอิเล็กตรอนดังนี้ 2 , 8 , 18 , 7 ดังนั้น Br จะอยู่ในหมู่ที่ 7 เพราะมีเวเลนซ์อิเล็กตรอน 7 และอยู่ในคาบที่ 4 เพราะมีจำนวนระดับพลังงาน 4
หลักการจัดเรียงอิเล็กตรอน
1. จะต้องจัดเรียงอิเล็กตรอนเข้าในระดับพลังงานต่ำสุดให้เต็มก่อน จึงจัดให้อยู่ระดับพลังงานถัดไป
2. เวเลนซ์อิเล็กตรอนจะเกิน 8 ไม่ได้
3. จำนวนอิเล็กตรอนในระดับพลังงานถัดเข้าไปของธาตุในหมู่ IA , IIA เท่ากับ 8 ส่วนหมู่ IIIA – VIIIA เท่ากับ 18
แบบจำลองอะตอมแบบกลุ่มหมอก
แบบจำลองอะตอมแบบกลุ่มหมอก แบบจำลองอะตอมของโบร์ ใช้อธิบายเกี่ยวกับเส้นสเปกตรัมของธาตุไฮโดรเจนได้ดี แต่ไม่สามารถอธิบายเส้นสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้ จึงได้มีการศึกษาเพิ่มเติม โดยใช้ความรู้ทางกลศาสตร์ควันตัม สร้างสมการเพื่อคำนวณหาโอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่างๆ จึงสามารถอธิบายเส้นสเปกตรัมของธาตุได้ถูกต้องกว่าอะตอมของโบร์ ลักษณะสำคัญของแบบจำลองอะตอมแบบกลุ่มหมอกอธิบายได้ดังนี้
1. อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสอย่างรวดเร็วตลอดเวลาด้วยความเร็วสูง ด้วยรัศมีไม่แน่นอนจึงไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้บอกได้แต่เพียงโอกาสที่จะพบอิเล็กตรอนในบริเวณต่างๆ ปรากฏการณ์แบบนี้นี้เรียกว่ากลุ่มหมอกของอิเล็กตรอน บริเวณที่มีกลุ่มหมอกอิเล็กตรอนหนาแน่น จะมีโอกาสพบอิเล็กตรอนมากกว่าบริเวณที่เป็นหมอกจาง
2. การเคลื่อนที่ของอิเล็กตรอนรอบนิวเคลียสอาจเป็นรูปทรงกลมหรือรูปอื่น ๆ ขึ้นอยู่กับระดับพลังงานของอิเล็กตรอน แต่ผลรวมของกลุ่มหมอกของอิเล็กตรอนทุกระดับพลังงานจะเป็นรูปทรงกลม
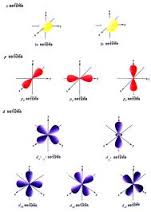
รูปทรงต่างๆของกลุ่มหมอกอิเล็กตรอน จะขึ้นอยู่กับระดับพลังงานของอิเล็กตรอน การใช้ทฤษฎีควันตัม จะสามารถอธิบายการจัดเรียงตัวของอิเล็กตรอนรอบนิวเคลียส ได้ว่าอิเล็กตรอนจัดเรียงตัวเป็นออร์บิทัล(orbital) ในระดับพลังงานย่อย s , p , d , f แต่ละออร์บิทัล จะบรรจุอิเล็กตรอนเป็นคู่ ดังนี้
s – orbital มี 1 ออร์บิทัล หรือ 2 อิเล็กตรอน
p – orbital มี 3 ออร์บิทัล หรือ 6 อิเล็กตรอน
d – orbital มี 5 ออร์บิทัล หรือ 10 อิเล็กตรอน
f – orbital มี 7 ออร์บิทัล หรือ 14 อิเล็กตรอน
แต่ละออร์บิทัลจะมีรูปร่างลักษณะแตกต่างกัน ขึ้นอยู่กับการเคลื่อนที่ของอิเล็กตรอนในออร์บิทัล และระดับพลังงานของอิเล็กตรอนในออร์บิทัลนั้นๆ เช่น
s – orbital มีลักษณะเป็นทรงกลม
p – orbital มีลักษณะเป็นกรวยคล้ายหยดน้ำ ลักษณะแตกต่างกัน 3 แบบ ตามจำนวนอิเล็กตรอนใน 3 ออร์บิทัล คือ Px , Py , Pz
d – orbital มีลักษณะและรูปทรงของกลุ่มหมอก แตกต่างกัน 5 แบบ ตามจำนวนอิเล็กตรอนใน 5 ออร์บิทัล คือ dx2-y2 , dz2 , dxy , dyz , dxz























ไม่มีความคิดเห็น:
แสดงความคิดเห็น